Vous êtes ici : ILVFRRechercheSynthèse organique (SORG)Composés fluorés et processus photo-induits
- Mis à jour le 18 octobre 2024
- Version PDF
Composés fluorés et processus photoinduits
Coordonnateur de l'axe
Membres permanents
Membres non permanents
Thématiques principales
Une des principales préoccupations de cet axe de recherche concerne l'exploration de méthodes douces, tardives et sélectives pour l'incorporation de groupes fluorés dans les molécules organiques. Des réactifs de perfluoroalkylation novateurs ont été récemment rapportés, ainsi que des nouvelles approches pour l'introduction d'entités fluorées, notamment par catalyse photoredox. Les résultats majeurs se concentrent essentiellement sur 3 thèmes principaux:
Les sulfoximines et dérivés
Nous avons élaboré une approche simplifiée, performante et novatrice de la synthèse des sulfoximines, substances originales et prometteuses en tant que réactifs ou groupes innovants. Les résultats principaux obtenus récemment concernent l’amélioration des voies d’accès aux sulfoximines fluorées, le développement de nouvelles sulfoximines pour une amélioration de leurs réactivités et une généralisation de leurs applications en méthodologie de synthèse. Ainsi, l'ANR (PRCI) HYPISUL, en partenariat avec le Professeur Antonio Togni (ETH Zürich), a notamment permis de décrire des structures inédites comprenant un iode hypervalent avec un ligand de motif sulfoximine fluorée. Ce nouveau réactif nous a permis de transformer directement des alcools en éthers trifluorométhylés correspondants, réaction extrêmement délicate à réaliser.
En ce qui concerne la modification du noyau aromatique, l'utilisation du groupe directeur sulfoximine NH libre s'est révélée être une stratégie efficace, permettant l'introduction de nombreux motifs en position ortho. Une étude RMN a permis de mettre en évidence les espèces impliquées dans cette réaction. Les sulfoximines ornées d'une fonction alcyne en position ortho ont été capables de subir une cyclisation sélective, donnant soit des benzothiazines, soit des benzothiazoles. Ces derniers ont ensuite été soumis à une oxydation pour obtenir le réactif d'Adachi, qui n'était jusqu'alors mentionné que dans un brevet japonais datant de 2005. En collaboration avec le Dr. Samir Messaoudi (BIOCIS), il a été possible de connecter sur le noyau aromatique des thioglycosides par deux méthodes : une catalyse au palladium ou une catalyse duale (Nickel-catalyse photoredox). Ces composés par réaction d’oxydation ont permis de développer une famille inédite d’analogues du réactif d’Adachi. L’introduction d’un atome de soufre à différents degrés d’oxydation modifie les propriétés de ces squelettes, en comparaison du réactif d’Adachi et en fait une bonne source de radicaux fluorés en catalyse photoredox.

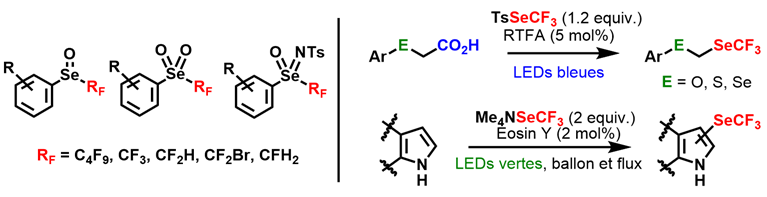
Atome de sélénium : SeCF3 et espèces oxydées
Par analogie avec les sulfoximines, les sélénoximines aromatiques fluorées n’avaient jusque-là jamais été décrites. Une étude méthodologique récente nous a permis d’accéder à une méthode efficace des différent états oxydés des sélénoéthers perfluorés, à savoir les sélénoxydes, les sélénones et les sélénoximines. Ce travail a été réalisé dans le cadre d’un projet ANR PRC en collaboration avec l’équipe du Dr. Thierry Billard (ICBMS Lyon). Au cours de ces recherches collaboratives, nous avons développé l’utilisation des réactifs de perfluoroalkylsélénolation. La réactivité du tosyl trifluorométhylsélényl (TsSeCF3) a été ainsi exploré. Ce dérivé peut participer à des réactions de type Morita-Baylis-Hillman. En utilisant des conditions douces et respectueuses de l'environnement, nous avons réussi à synthétiser des cétones α,β-insaturées contenant un motif SeCF3. Initialement électrophile, la réactivité du TsSeCF3 a pu être inversée en générant in situ l'anion CF3Se- (processus "umpolung"), qui a pu ensuite réagir sur des bromoalkyles pour former les sélénoéthers correspondants. Nos compétences en catalyse photoredox nous ont aussi permis de développer une réaction de trifluorométhylsélénolation décarboxylante utilisant la riboflavine tétraacétylée comme photocatalyseur et le TsSeCF3 comme agent de sélénofluoration. Nous avons ainsi pu isoler de nouveaux groupes fluorés séléniés de type ECH2SeCF3 et mesurer leur lipophilie (SeCH2SeCF3 ayant la plus élevée connue à ce jour). De plus la catalyse photoredox, mise en œuvre sans l'utilisation de métaux mais en utilisant l'éosine comme catalyseur s'est avérée très efficace pour générer pour la première fois des radicaux SeCF3 à partir du réactif de trifluorométhylsélénolation nucléophile, [Me4N][SeCF3]. Cela a permis d’introduire le motif SeCF3 sur différents noyaux hétéroaromatiques. La formation des espèces radicalaires a été mise en évidence par RPE spin trapping.
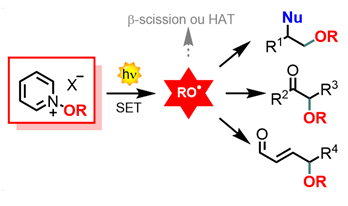
Catalyse photorédox
En plus des nouvelles réactivités photocatalytiques développées avec nos nouveaux réactifs évoqués plus haut (perfluoroalkylation, perfluoroalkylsélénolation), un axe important de nos recherches s’est attaché à la génération de radicaux oxygénés par catalyse photoredox. Grâce à l’utilisation de sels de pyridinium comme précurseur de ces radicaux, nous avons pu développer des formations radicalaires de liaisons C-O inédites, en piégeant les radicaux alcoxy avec des substrats adéquats tels que des alcènes ou des éthers d’énol silylés. Cette dernière réactivité a également pu être généralisée au radical ·OCF3, en partenariat avec les Professeurs A. Togni (ETH Zürich) et Luca Dell’Amico (Université de Padova). Les éthers de diénol silylés ont quant à eux montré à une sélectivité très intéressante en faveur de la position γ, et ce nouveau type de γ-fonctionnalisation d’énals a ensuite pu être étendu à d’autres radicaux azotés ou carbonés, ainsi qu’aux radicaux perfluoroalkyles grâce à nos sulfoximines. On peut également noter que la plupart de ces réactions photocatalytiques ont pu être adaptées en chimie de flux continu, technique qui a aussi été mise à profit pour la mise au point de réactions de cyclisation de type Prins. Cette thématique est en lien avec l’axe Catalyses et Hétérocycles pour tenter de développer ces méthodes en version asymétrique par activation organocatalysée.